 , avec leurs avantages et leurs inconvénients.
, avec leurs avantages et leurs inconvénients.
Le projet DIATELIC est situé dans le cadre de la télémédecine et, de manière plus spécifique, de la surveillance de patients dialysés traités à leur domicile par une dialyse péritonéale continue ambulatoire. Je vais donc commencer par expliquer la nature des troubles médicaux dont souffrent les patients avant de présenter les objectifs de ce projet et les moyens techniques que cela implique.
L'insuffisance rénale conduit à une perte graduelle des facultés d'épuration de l'organisme et à une atteinte de la régulation hydrique. Cette pathologie nécessite la mise en œuvre de soins palliatifs au dysfonctionnement des reins. Pour ces soins, deux grandes approches sont envisageables : la greffe d'un ou plusieurs reins, et la dialyse. La première nécessite évidemment la disponibilité d'un donneur compatible, ce qui reste un cas assez rare. La seconde est donc souvent utilisée dans l'attente d'un donneur éventuel.
La dialyse est un processus qui consiste à filtrer le sang du patient, complétant ou remplaçant le travail fait normalement par les reins. L'objectif de ce filtrage est multiple, car le rein a de nombreuses fonctions. Ainsi, il est chargé de la régulation de l'hydratation du corps, et de l'élimination de différentes toxines. Actuellement, trois grandes méthodes de dialyses sont utilisées régulièrement : l'hémodialyse, la dialyse péritonéale automatisée (DPA), et la dialyse péritonéale continue ambulatoire (DPCA).
L'hémodialyse est l'approche la plus ancienne, puisqu'elle a été étudiée chez l'animal dès 1912 par Abel, Rowntree et Turner. Cependant, la première dialyse d'un être humain réalisée avec succès n'a été obtenue qu'en 1945. A partir de 1960, grâce aux progrès réalisés sur les reins artificiels, cette méthode s'est progressivement généralisée. Elle peut en effet s'appliquer à la plupart des patients, avec très peu de restrictions. Cette méthode consiste à créer une circulation sanguine extracorporelle. On fait donc passer une partie du flux sanguin du patient à travers une machine qui filtre les résidus toxiques et régule la quantité d'eau présente dans le sang. En général, chacune de ces séances dure plusieurs heures, et deux à trois séances sont nécessaires par semaine. Il s'agit donc d'un traitement lourd et difficile à supporter par les patients, puisqu'il nécessite leur présence dans un centre de dialyse, plusieurs nuits par semaine.
Ganter, dès 1923, a proposé une nouvelle méthode de dialyse : la dialyse
péritonéale. Cette approche consiste à utiliser le péritoine comme filtre
naturel. Elle a donc été beaucoup plus facile à mettre en œuvre que
l'hémodialyse, puisqu'elle ne nécessite pas de circulation sanguine extracorporelle.
En particulier, cette méthode ne souffre d'aucun problème lié à la
coagulation du sang dans les tubulures. Elle est donc particulièrement adaptée aux patients
tolérant mal les traitements anticoagulants. Néanmoins, avec les améliorations
successives des reins artificiels, de plus en plus faciles à mettre en œuvre et de plus en
plus sûrs, l'utilisation de cette technique a beaucoup diminué depuis 1960. Les
différents types de dialyse péritonéale sont discutés dans
 , avec leurs avantages et leurs inconvénients.
, avec leurs avantages et leurs inconvénients.
Le péritoine est une poche naturelle, située dans l'abdomen, qui sépare en particulier les organes vitaux des côtes. La paroi de cette poche possède de très nombreux vaisseaux sanguins de petite taille, les capillaires, qui irriguent toute sa surface pariétale. Cela fait du péritoine un site idéal de transfert osmotique. L'osmose est un phénomène physique qui permet à une solution de traverser une paroi semi-perméable : lorsqu'une paroi semi-perméable sépare deux liquides dans lesquels sont dissous des éléments, on peut observer que la quantité de ces éléments de chaque côté de la paroi (la concentration de chacune des solutions) s'équilibre progressivement. La paroi des capillaires étant suffisamment fine pour permettre cet échange, il est possible d'utiliser le péritoine comme filtre osmotique naturel.
Le patient est donc opéré afin d'ajouter un cathéter au bas du péritoine, en ménageant une sortie à travers la paroi abdominale. Cette émergence, comme l'appellent les néphrologues, permet alors de remplir le péritoine avec environ deux litres d'une solution de sérum physiologique. Cette solution contient des additifs qui permettent de faire varier l'effet de ce rein artificiel. Par exemple, en augmentant sa concentration, l'osmose va drainer plus d'eau vers le péritoine de façon à diminuer la concentration de la solution qui s'y trouve. Inversement, si l'on injecte une solution dont la concentration est inférieure à celle du sang, l'eau contenue dans le péritoine va être transférée vers le flux sanguin de façon à équilibrer les concentrations. En fonction de la nature de l'additif, selon qu'il est absorbé ou non par le flux sanguin, le transfert sera plus ou moins régulier tout au long de la stase. Les principaux additifs utilisés sont le glucose, qui est absorbé par l'organisme, et l'icodextrine qui ne l'est pas.
De façon évidente, il convient de surveiller régulièrement l'état de l'émergence, car elle est très sujette à inflammation, et une infection est à craindre à chaque manipulation. Or une dialyse péritonéale peut demander de nombreuses manipulations à chaque changement de la solution. C'est donc une source possible de troubles liés à cette méthode. Néanmoins, cette dernière ne nécessite pas l'emploi de substances anticoagulantes, puisqu'aucune circulation extracorporelle n'est employée.
La DPA utilise ce principe : le patient se rend dans un centre de dialyse, où son émergence est reliée à une machine qui va successivement préparer, injecter, laisser reposer et retirer plusieurs litres de sérum physiologique. A chaque transfert, le poids du fluide est mesuré avant et après la dialyse, et le différentiel correspond à peu près à la quantité d'eau qui a été drainée. Le médecin responsable du traitement peut donc paramétrer l'opération de façon à maintenir le patient dans un état de santé correct. En effet, la machine propose d'ajuster la concentration de la solution à injecter en mélangeant divers produits selon les directives du médecin. De même que pour la dialyse standard, c'est un traitement lourd, qui dure plusieurs heures, et qui est répété plusieurs fois par semaine.
Finalement, la DPCA constitue l'une des dernières avancées de la dialyse
 . Son principal avantage est de pouvoir s'effectuer au domicile des patients, et non en centre
spécialisé. Pour arriver à ce résultat, le patient doit remplir lui-même
son péritoine avec des poches de sérum étalonnées. Trois principaux types de
poches, de concentrations différentes, sont utilisés : les isotoniques, les hypertoniques, et
les medium, de concentration intermédiaire. Les poches isotoniques ont une concentration
approximativement égale à celle de l'organisme, alors que les poches hypertoniques sont
plus concentrées que les deux autres.
. Son principal avantage est de pouvoir s'effectuer au domicile des patients, et non en centre
spécialisé. Pour arriver à ce résultat, le patient doit remplir lui-même
son péritoine avec des poches de sérum étalonnées. Trois principaux types de
poches, de concentrations différentes, sont utilisés : les isotoniques, les hypertoniques, et
les medium, de concentration intermédiaire. Les poches isotoniques ont une concentration
approximativement égale à celle de l'organisme, alors que les poches hypertoniques sont
plus concentrées que les deux autres.
Un patient utilise trois à quatre poches par jour. Une poche reste en stase pendant environ 4 heures dans le péritoine, temps pendant lequel le filtrage osmotique se déroule naturellement. Au bout de 4 heures, le système lymphatique qui draine en permanence le contenu du péritoine a absorbé suffisamment du sérum mis en stase pour que le transfert s'inverse. Conserver plus longtemps la poche n'apporte donc pas d'amélioration.
Lorsque le patient retire la poche, il la pèse et consigne cette valeur sur une fiche. Il doit également noter le niveau de turbidité de la poche en lisant un code situé au dos de l'étiquette de la poche, à travers le liquide qu'elle contient. Cette lecture permet donc de juger facilement si une poche est trouble, ou si elle est limpide. Une poche trouble est en effet un indice de la présence de fibres, ce qui peut révéler un début de pathologie ou de détérioration du péritoine.
A part l'injection quotidienne de leurs poches et la mesure de quelques paramètres médicaux, les patients traités en DPCA peuvent vivre presque normalement. Cette méthode de soin est donc la plus agréable à vivre pour eux, puisqu'ils retrouvent une grande partie de leur autonomie. Elle pose cependant de graves problèmes quant à leur sécurité. En effet, puisque les patients opèrent leur dialyse tous seuls, à domicile, la surveillance qu'assurent les médecins est fortement amoindrie. Pour améliorer leur sécurité, les patients sont donc suivis par leur néphrologue à raison d'une visite mensuelle. Pour accroître encore cette sécurité, une infirmière peut passer voir le patient régulièrement. Cela lui permet de juger de l'état général du patient et de l'aider dans ses soins. Par exemple, elle peut prendre la tension, surveiller l'état de l'émergence et évaluer le niveau de turbidité des poches. Enfin, l'infirmière doit surtout avertir le médecin dans le cas où elle suspecte un problème. L'infirmière est donc plus particulièrement recommandée pour les patients qui ne sont pas totalement autonomes.
Les risques sont essentiellement liés aux erreurs de manipulations qui peuvent entraîner des infections graves telles que des péritonites, et à une mauvaise gestion du niveau d'hydratation du patient. Il convient donc de surveiller étroitement ce paramètre. Cependant, comme les reins continuent un certain temps à éliminer une partie de l'eau superflue et que le patient continue à boire et à manger normalement, l'évolution de l'hydratation du patient est difficile à prédire. Son évaluation se base principalement sur la surveillance du poids. C'est en effet un paramètre médical particulièrement facile à mesurer, et qui est directement lié à l'hydratation du patient. Simplement, si le poids du patient augmente d'un kilogramme en une journée, il y a un risque non négligeable que ce soit un kilogramme d'eau stocké par le patient. Pour que cette estimation soit pertinente, tout en lissant les variations journalières du poids, une valeur de référence stable est nécessaire. Cette dernière est calculée à l'hôpital dans la période qui précède le retour du patient chez lui. Ce poids de référence est nommé poids-sec par les médecins.
Une mauvaise estimation du poids-sec par le médecin peut entraîner des troubles tels que des hyperhydratations ou des déshydratations en faussant le jugement du niveau d'hydratation du patient par le médecin. Par exemple, un poids-sec trop élevé peut amener à considérer une situation normale comme une déshydratation, puisque le poids est au-dessous de sa valeur supposée idéale. Le médecin va alors vouloir réduire l'intensité du traitement, de façon à permettre à l'organisme de retrouver son équilibre en accumulant plus d'eau. Comme le patient était en réalité dans un état d'hydratation normale, il va tendre vers un état d'hyperhydratation imposé par le traitement. Il est donc nécessaire de bien évaluer le poids-sec de chaque patient afin de pouvoir considérer le poids comme un indicateur fiable.
Bien entendu, le patient peut maigrir ou grossir de façon naturelle, ce qui impliquera une réévaluation du nouveau poids-sec. Tout le problème vient alors de cette ambigüité entre la détection d'un poids-sec mal réglé et la détection d'un trouble de l'hydratation. En effet, comme le patient reste à son domicile durant le traitement, cette détection ne peut se baser que sur la variation des paramètres physiologiques. Or, une augmentation de poids peut aussi bien être due à une prise de poids naturelle qu'à une rétention d'eau. Séparer ces deux causes est donc un problème difficile, mais primordial. Heureusement, une variation de l'hydratation d'un patient donné à d'autres influences. Pour la détecter, il faut donc rechercher plusieurs paramètres médicaux concordants, tels par exemple le poids et la tension artérielle qui évoluent de concert.
Les troubles de l'hydratation sont particulièrement importants à diagnostiquer, car ils
peuvent avoir des effets à court terme et à long terme très graves. De plus,
l'installation de ces troubles peut se faire de façon très insidieuse. Une
hyperhydratation prolongée peut ainsi entraîner l'apparition d'œdèmes.
Les œdèmes sont des poches d'eau situées anormalement, comme par exemple dans les
poumons, ce qui est le cas le plus fréquent. Une hyperhydratation va également
entraîner une hausse de la tension artérielle, qui va à son tour perturber
l'organisme. Une analyse plus précise de ces troubles est menée dans
 .
.
L'hyperhydratation est un trouble particulièrement vicieux, car le patient ne montre aucun signe extérieur d'une quelconque maladie. Bien souvent, ses proches lui trouvent plutôt une bonne mine, au contraire de la déshydratation qui est accompagnée de signes très visibles. Pourtant, on peut souvent constater a posteriori que l'étude attentive des données de dialyse rassemblées dans les jours précédant l'apparition d'un oedème aurait pu permettre de le prévoir, et donc de l'éviter. C'est donc l'un des objectifs primordiaux de notre projet.
L'architecture que nous avons développée est basée sur le principe du client-serveur. Un serveur est dédié à l'analyse et au stockage des données des patients, et reste disponible en permanence; les postes clients sont répartis chez chaque patient d'une part, et à disposition des différents médecins d'autre part. Les patients sont connectés au système grâce au réseau téléphonique classique, en utilisant un simple modem. La sécurité des données est assurée d'une part par une identification qui supprime toutes les informations nominatives, grâce à un système de login et de mot de passe. D'autre part par un système de rappel du patient par le serveur permet d'accroître encore cette sécurité. En effet, chaque patient a un numéro fixe à partir duquel il peut se connecter au système. Lorsqu'il désire envoyer ses données journalières, il appelle le serveur et s'identifie. Le serveur appelle alors le numéro correspondant à l'identifiant utilisé, afin d'effectuer le transfert des données.
Les postes des médecins sont reliés au serveur grâce au réseau Internet. L'identification est réalisée également par un système de mot de passe permettant de protéger l'accès aux données stockées par le système. La confidentialité des données est assurée par le fait que toutes les données sont anonymes. Seuls les médecins ont la liste de la correspondance entre l'identifiant d'un patient et son identité. De cette façon, seuls les identifiants circulent sur le réseau. De même, les données sont stockées dans une base de donnée sans aucune référence à l'identité réelle des patients. Seul l'identifiant fourni par les médecins est conservé. Un piratage éventuel des données utilisées par le système serait donc difficilement exploitable.
Chaque jour, chaque patient entre ses données dans une fiche informatisée qui remplace la fiche papier habituelle. Ces deux fiches ont une présentation similaire, de façon à permettre une adaptation aisée des patients et des médecins au système.
On peut donc voir la similitude entre ces deux fiches, ainsi que la relative pauvreté des données qu'elles contiennent. En plus de la traditionnelle fiche où sont consignées les données médicales, une messagerie électronique est mise à la disposition des patients. Celle-ci permet de faciliter la communication entre les néphrologues et leurs patients. De cette façon, les patients peuvent laisser des messages à destination des médecins et peuvent leur poser des questions. En retour, l'équipe médicale peut répondre par la même messagerie ou, si le besoin s'en fait sentir, par téléphone. Les médecins ont remarqué que cette messagerie a permis aux patients de poser plus de questions qu'ils ne le font habituellement. En effet, le médecin peut consulter les messages quand il en a le temps. Un appel téléphonique, au contraire, peut tomber au beau milieu d'une consultation, ou d'une autre tâche urgente. Les patients ont donc moins de scrupules à poser des questions qu'ils jugent peu importantes, ou non urgentes. Par effet de bord, cela permet donc d'augmenter la compréhension du patient envers sa maladie, son traitement, et ainsi de suite. On peut donc espérer en retirer un gain au niveau de l'application des directives des néphrologues. Ce gain a été observé, mais il est difficile de déterminer s'il est dû à la messagerie, ou au sentiment d'être mieux suivi.
Lorsque le patient valide sa fiche de données quotidienne, celle-ci est transmise directement au serveur où elle est consultable à volonté par les médecins. En parallèle, un système intelligent analyse ces données et les compare au profil du patient. L'objectif premier de ce module consiste à générer des alertes dans le cas où l'évolution des paramètres médicaux semble annoncer une pathologie. Il se doit donc d'être suffisamment sensible pour détecter des évolutions insidieuses, mais suffisamment discriminant pour ne pas alerter les néphrologues sans raison valable. Grâce à un tel système, les médecins devraient pouvoir suivre plus de patients, tout en disposant de plus de temps pour gérer les problèmes de chacun.
Etant donné l'ampleur du projet, il est évident que l'étude et la mise en place d'un tel système a demandé la participation active de nombreuses personnes, incluant en particulier l'équipe médicale de l'ALTIR, et de nombreux chercheurs du LORIA. Ma contribution à ce projet s'est limitée à l'étude, la conception et la maintenance du système de diagnostic informatisé. Ce module est en effet l'une des contributions majeures de mes recherches.
Une expérimentation sur 30 patients a débuté en 1999 et s'est terminée en
août 2002. Bien que tous les résultats ne soient pas encore dépouillés, je peux
déjà indiquer que les résultats sont très encourageants, et même parfois
au-delà de nos espérances. Pour cette raison, trois brevets ont été
déposés
 , et une société destinée à offrir des services de ce type à une
échelle plus importante a été créée : DIATELIC S.A.
, et une société destinée à offrir des services de ce type à une
échelle plus importante a été créée : DIATELIC S.A.
Quotidiennement, chaque patient envoie sa fiche au serveur. Le système doit alors analyser les données qu'elle contient de façon à alerter le médecin si une anomalie est détectée. Pour comprendre comment s'appliquent les algorithmes que je vais présenter dans les prochains chapitres, il est nécessaire de connaître les données médicales disponibles pour analyser l'état de chaque patient. Je vais donc expliciter chacun de ces paramètres, en expliquant leur source, leur nature, leur intérêt au point de vue médical, et les problèmes que pose leur exploitation.
Le poids est mesuré par un pèse-personne classique. Cette valeur est comparée au poids-sec, valeur idéale fixée par le médecin. Comme chaque litre d'eau stocké par le patient pèse 1 kilogramme, cette comparaison fournit une appréciation directe de l'hydratation du patient. Cette mesure est pertinente, à condition cependant que la valeur de référence soit bien conforme à la physiologie actuelle du patient. Il est donc nécessaire de faire évoluer le poids-sec lorsque le patient grossit, ou lorsqu'il maigrit. Cette valeur est relativement sujette à des variations journalières, et plus particulièrement en fonction des repas que consomme chaque patient, de la température, et des efforts fournis par le patient.
La tension artérielle est prise par un système standard de brassard et de stéthoscope. Chaque jour, deux mesures sont effectuées. La première valeur est obtenue pendant que le patient est allongé, et la seconde est prise lorsqu'il se lève. Chacune de ces mesures donne deux valeurs différentes, basées sur le bruit que génère la pulsation du flux sanguin dans les vaisseaux : la tension systolique et la tension diastolique. Néanmoins, pour les besoins du calcul, nous avons besoin d'une valeur de tension unique. Nous utilisons donc la définition de la tension moyenne que l'on utilise classiquement en médecine :
TensionMoyenne = (Systolique+2*Diastolique)/3
En règle générale, la tension moyenne reflète assez finement le niveau d'hydratation du patient. En effet, plus le flux sanguin contient d'eau, plus son volume augmente. Plus le volume augmente, plus la pression exercée sur les parois des vaisseaux sanguins s'accroît. Finalement, plus cette pression augmente, plus la tension artérielle s'élève, et plus il faudra gonfler le brassard pour en masquer le bruit. Cette évolution dépend naturellement de l'élasticité des artères, valeur qui évolue naturellement avec l'âge du patient. Il est bon de noter que l'effet observé est exactement l'inverse chez un patient qui souffre d'insuffisance cardiaque.
Lorsque l'on étudie l'évolution de la tension d'un patient donné, on peut remarquer que cette dernière évolue naturellement, de façon assez lente, mais cyclique. Ses variations brusques sont donc plus intéressantes que sa valeur numérique brute. Cependant, pour éviter les aléas dus à des valeurs localement anormales, il est préférable de ne pas comparer la valeur du jour à la seule valeur de la veille. En effet, une augmentation localisée de la tension se traduirait alors par une baisse brutale de cette dernière dès le lendemain.
Bien entendu, il est nécessaire d'éliminer ces effets contradictoires et sans relation avec l'hydratation pour obtenir un diagnostic correct. Pour avoir une idée de la tension normale d'un patient typique, les médecins utilisent une moyenne portant sur la période des 15 jours précédant la consultation ; le système pourra donc comparer également la valeur de la tension quotidienne avec une valeur moyenne, calculée sur les 15 derniers jours de données envoyées par le patient. De cette façon, la mesure obtenue est comparable à celle utilisée par les médecins.
La différence entre les valeurs quotidiennement mesurées pour la tension lorsque le patient est debout et lorsqu'il est couché est nommée tension orthostatique. Cet indicateur est également révélateur de l'état d'hydratation général du patient. Normalement, la tension qui est mesurée lorsque le patient est couché est légèrement supérieure à celle qui est mesurée lorsqu'il passe à une position verticale. En effet, la gravité tire alors brutalement le sang vers le bas du corps, ce qui réduit la pression observée dans les membres supérieurs.
Lorsque le patient se déshydrate, cette tendance s'amplifie, car le volume sanguin est insuffisant pour assurer le maintien de la pression. On observe alors une chute brutale de la pression artérielle, connue sous le terme d'hypotension orthostatique. C'est donc un facteur de diagnostic particulièrement intéressant, puisqu'il ne fait aucune référence à l'état moyen du patient. Ainsi, même chez un patient en début de traitement, cette valeur est suffisamment significative pour être utilisée directement. De plus, même lorsque le patient souffre d'une hypotension, ce facteur est clairement mesurable.
Par contre, ce facteur n'est pas influencé par un problème d'hyperhydratation. Il ne peut donc pas révéler toutes les pathologies liées à l'hydratation.
Le bas de la fiche contient le détail des poches utilisées pendant la journée par le patient. Pour chacune d'entre elles, la concentration du sérum est indiquée sous la forme du type de poche que le patient a utilisé. Additionnellement, l'heure à laquelle chaque poche a été injectée dans le péritoine, et l'heure à laquelle elle en a été retirée sont reportées dans les colonnes correspondantes.
De plus, chaque poche est pesée avant et après la dialyse, de façon à permettre l'analyse de l'effet de chacune d'entre elles. La différence de ces poids permet donc d'apprécier rapidement la quantité d'eau qui a été drainée pendant que le sérum résidait dans le péritoine. Cependant, on observe que les patients réagissent de façon très différente à un même type de poche, et, de plus, cela évolue au cours du temps. Il est donc nécessaire d'étalonner chaque type de poche pour chaque patient. Par similarité avec la tension, nous utilisons également une moyenne sur quinze jours pour apprécier le différentiel attendu par type de poche.
Cela pose néanmoins de gros problèmes, car certaines poches sont utilisées relativement rarement par certains patients. Les valeurs attendues dans ce cas sont donc assez incertaines. Néanmoins, cette approche permet de tenir compte de l'évolution du patient tout au long de son traitement. Enfin, un patient utilise plusieurs poches par jour. Il n'est pas rare d'observer un déficit sur une poche, compensé par un surplus sur l'une ou l'autre des poches suivantes. Cela reste tout à fait normal. Le différentiel cumulé de toutes les poches est connu des médecins sous le nom d'ultrafiltration.
Théoriquement, plus le patient est hydraté, plus l'ultrafiltration est importante. En effet, plus le sang contient d'eau, plus sa concentration baisse. Une même concentration de sérum aura donc tendance à drainer plus de liquide pour équilibrer les concentrations lors de l'osmose. Cependant, les différentes poches utilisées dans une journée peuvent être de type différent afin d'obtenir une dialyse plus fine. J'ai en effet déjà indiqué que les patients utilisaient majoritairement trois types de poches. Utiliser plusieurs types de poches dans une même journée permet donc d'obtenir une dialyse qui pourrait provenir de poches ayant des concentrations intermédiaires. Or cette variation de concentration au cours de la journée rend difficile l'appréciation de la quantité d'eau drainée dans la journée. En effet, le patient réagissant différemment à divers types de poches, il est difficile de savoir si un échange est normal, ou s'il est excédentaire.
Enfin, certains patients gardent leur péritoine rempli durant la nuit, alors que d'autres non ; les poches nocturnes restent plus longtemps que les autres en stase. Le débit observé est donc sensiblement différent, d'autant plus qu'un phénomène de réabsorption a tendance à se produire. En effet, en fin de dialyse, le sens du transfert osmotique tend à s'inverser. Cet effet a donc tendance à diminuer le différentiel de la poche nocturne. En définitive, l'importance des données issues de l'ultrafiltration est très discutée, et il est difficile de dire aujourd'hui si c'est un indicateur fiable de l'hydratation ou pas. Cependant, les néphrologues sont certains que c'est un indice important quant à la détection de troubles liés au péritoine. Par exemple, cela pourrait servir à détecter l'apparition de péritonites.
Le module de diagnostic situé au coeur de DIATELIC a été conçu à l'aide de l' interface de création d'agents intelligents que j'ai réalisée durant ma thèse.
Le module est organisé autour d'un modèle Markovien partiellement observable (HMM) dont les états représentent les conditions pathologiques du dialysé. A partir de là, l'état du patient sera évalué par sa probabilité d'appartenance à chacune de ces situations. Nous avons donc un modèle à 5 états, centré sur une situation idéale du patient. Cette position est l'état principal du modèle, car c'est l'état de bonne santé dans lequel les médecins tentent de maintenir leurs patients.
Autour de cette situation idéale, nous avons décidé de représenter des variations réparties sur deux axes : l'hydratation et la qualité du règlage du poids-sec. Nos 5 états sont donc normal, déshydraté, hyperhydraté, poids-sec trop haut, et poids-sec trop bas. Les conjonctions des anomalies du poids-sec et de l'hydratation n'ont pas été modélisées, car une mauvaise évaluation du poids-sec fausse l'appréciation de l'état d'hydratation du patient. Une situation où le poids-sec est inférieur au poids idéal d'un patient qui est simultanément déshydraté va donc correspondre à deux états du model. La transition de l'un à l'autre dépend fortement de l'importance relative des deux anomalies.
Voici le diagramme correspondant :
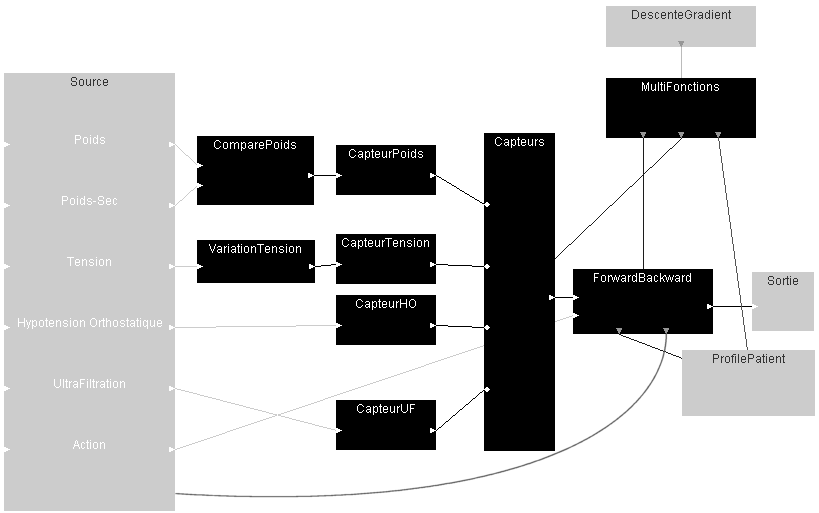
L'adaptation du modèle au patient se fait par le biais d'une descente de gradient dotée d'une relaxation adaptée. Précisions à venir.
La tension artérielle est évaluée en la comparant à sa moyenne des 15 derniers jours, pour ce patient précis.
Chaque signal médical est projeté sur une variable floue à trois valeurs: normale, faible, ou forte. Les probabilités résultantes sont alors comparées à la fonction d'observation de notre patient. On obtient alors une probabilité par capteur et par état, soit 20 probabilités.
La fonction d'observation exprime donc la probabilité d'observer, pour un patient donné, chacune des valeurs floues dans chacun des états du système. Voici les observations caractérisant notre patient moyen :
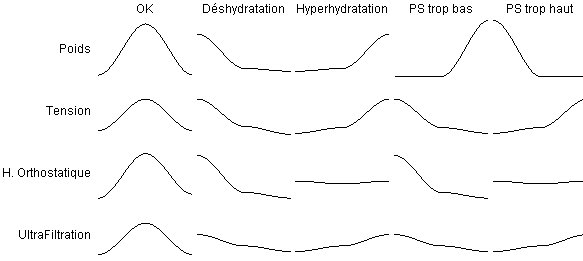
Les différentes probabilités issues des capteurs, pris indépendament les uns des autres, sont aggrégées en supposant une indépendance des capteurs, l'état du patient étant connu. l'idée consiste à dire que le fait d'être déshydraté, par exemple, est la seule influence directe des capteurs. Autrement dit, nous supposons que le poids, par exemple, n'a pas d'influence sur l'ultrafiltration ou la tension d'un patient déshydraté. Il s'agit bien sûr d'une hypothèse simplificatrice.
Le diagnostic proprement dit est effectué à partir de la probabilité d'observation agrégée de l'ensemble des capteurs. Il s'agit d'une simple application de l'algorithme Forward, qui nous donne la probabilité de chaque état à chaque instant. Grace à la sémantique que nous avons imposée aux états du modèle, ces probabilités sont directement interprétables par les médecins.
La partie du modèle commune à tous les patients contient en particulier la matrice de transition pour chacune des actions. Dans le cadre de DIATELIC, une seule action a été modélisée, car nous ne disposions pas de données suffisantes pour permettre d'apprendre une matrice (25 probabilités) pour chaque combinaison de traitements médicaux possibles. Nous avons donc modélisé une simple inertie temporelle : un patient ne peut pas changer radicalement d'état en une journée. L'évolution de l'état du patient est neutre, car elle intègre aussi bien les traitements médicaux que les conditions climatiques ou la nature des repas consommés.